 该论文展示了澳大利亚昆士兰大学张润博士课题组开发的次氯酸响应性比率光声纳米探针(AuNRs@SiO2-CAA)及其应用于癌症治疗过程中炎症反应的跟踪。研究中,通过监测AuNRs@SiO2-CAA在680和820 nm处比率光声信号的变化,精准监控了肿瘤和炎症高活性的标志物次氯酸的水平,从而实现了癌症检测和光热疗法中的炎症监测。这一成果为癌症诊疗提供了创新工具,助力及时干预癌症,并有望通过精确控制治疗过程中的炎症,提高光热疗法的疗效。 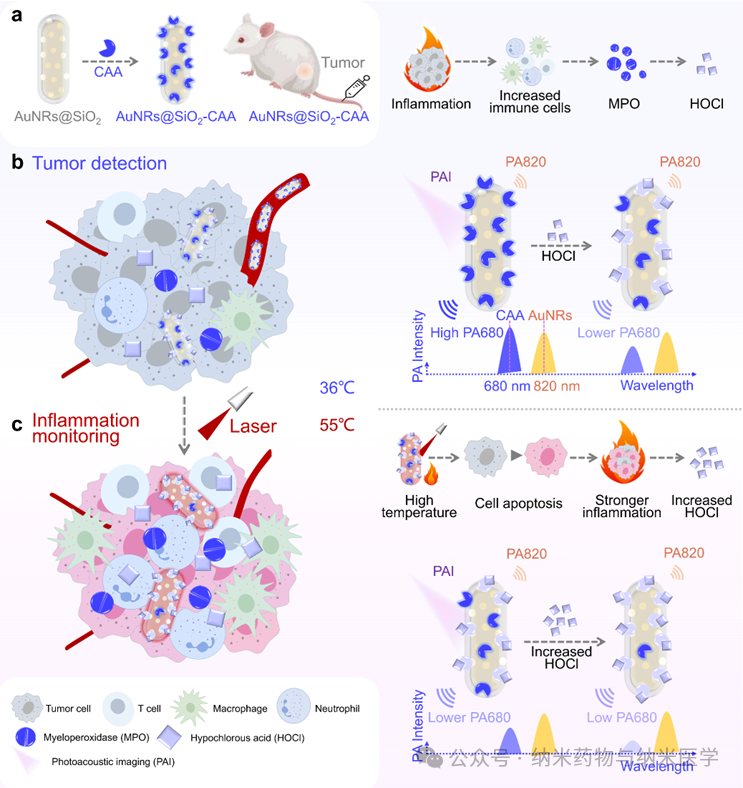 图1 次氯酸响应型诊疗一体化光声纳米探针AuNRs@SiO2-CAA的示意图:a) AuNRs@SiO2-CAA的合成路线及其在b) 癌症检测和c) 光热疗法过程中炎症进展的原位监测中的应用。 在体外,AuNRs@SiO2-CAA展现出了对HOCl快速的反应能力和高选择性,以及良好的生物相容性和优异的光热转换效率,这使其在HOCl检测,体内应用以及PTT方面中具有较大优势(图2)。此外,AuNRs@SiO2-CAA检测不同来源(外源性,MPO催化生成的,以及内源性)的HOCl的能力也得到了证实,其在体外对HOCl的检测限可低至0.34 µM(图3)。 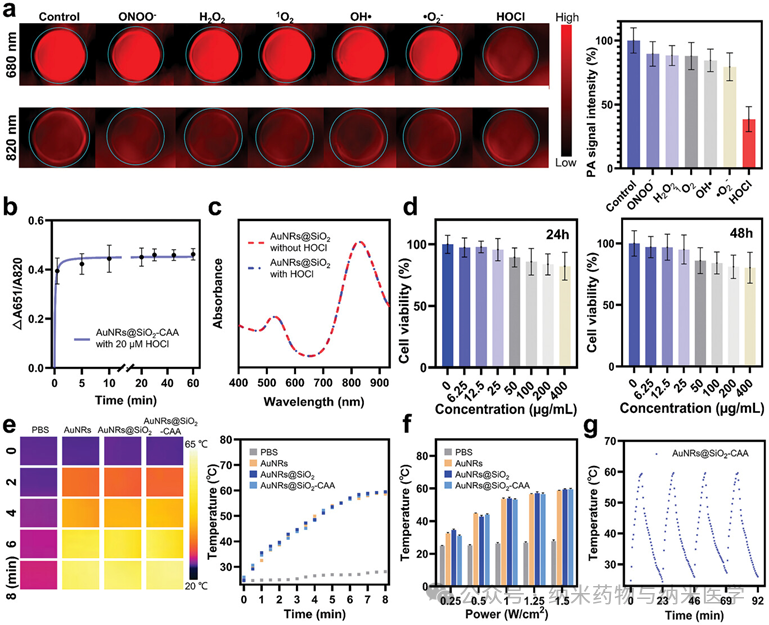 图2 AuNRs@SiO2-CAA的HOCl反应性、生物相容性和光热特性。a) AuNRs@SiO2-CAA对HOCl的选择性。b) AuNRs@SiO2-CAA对HOCl的反应速度。c) AuNRs@SiO2在存在和不存在HOCl条件下的紫外吸收光谱。d) AuNRs@SiO2-CAA的细胞毒性。e-g)AuNRs@SiO2-CAA的光热性能。 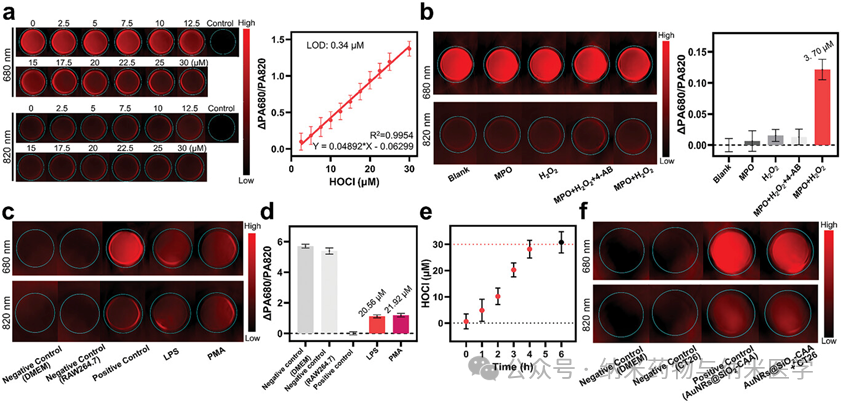 图3 使用AuNRs@SiO2-CAA检测外源性、由MPO催化生成的和内源性HOCl。a) 外源性HOCl的检测。b) 由MPO生成的HOCl的检测。c-f) 内源性HOCl的检测。 在体内,以AuNRs@SiO2-CAA为光敏剂驱动的PTT有效提高了肿瘤局部温度,并显著抑制了肿瘤的生长(图4)。研究者们全程监控了AuNRs@SiO2-CAA在680和820 nm处的PA信号,证实了比率PA探针检测肿瘤和炎症的能力,并记录了PTT过程中炎症发展的趋势(图5)。 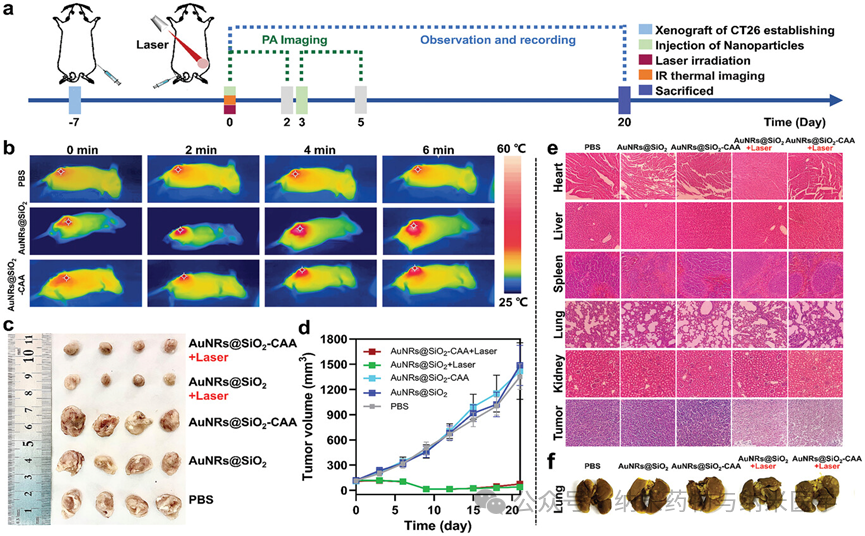 图4 AuNRs@SiO2-CAA在体内PTT效果的评估。a) CT26肿瘤异种移植建立、给药、监测和治疗时间线的示意图。b)注射后12小时,在肿瘤区域进行激光照射后的红外热成像。c)治疗结束后从各组小鼠收集的肿瘤的图像。d) 各组小鼠肿瘤体积与治疗时间的变化关系。e) 各组组织切片的H&E染色结果。f) 各组小鼠解剖的肺部的代表性图像。 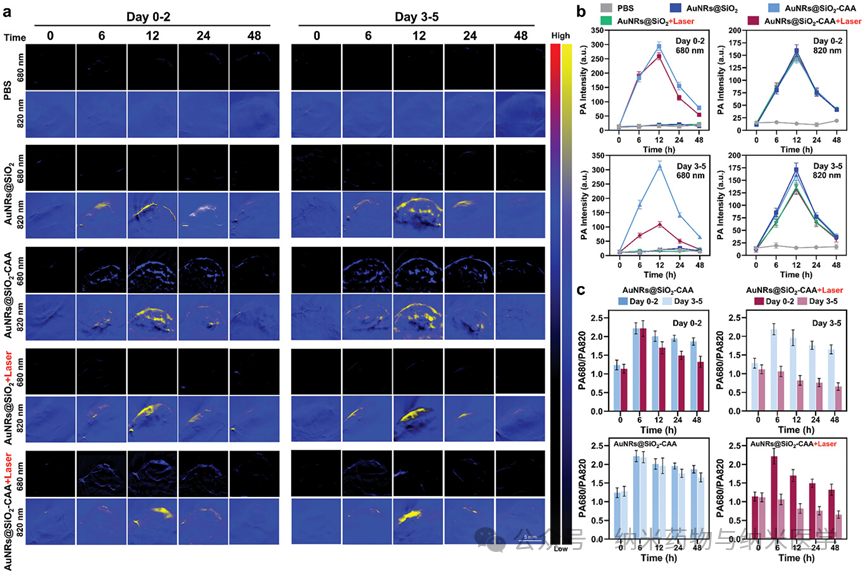 图5 使用AuNRs@SiO2-CAA对肿瘤区域HOCl的生成进行实时监测。a) 通过静脉注射AuNRs@SiO2-CAA获取肿瘤区域在进行PTT后0–2天和3–5天内的光声图像。b) 图a) 中各组小鼠肿瘤区域的光声强度,以及c) 光声强度比(PA680/PA820)的定量分析。 总而言之,该研究针对当前癌症检测和治疗中的不足,开发了AuNRs@SiO2-CAA——一个诊疗一体化纳米工具。该工具可以通过先进的PA成像技术灵敏地检测癌症,驱动PTT,并实时监控PTT中的炎症进展。在体内实验中,静脉注射的AuNRs@SiO2-CAA在肿瘤部位大量积聚,其比率PA信号强度与肿瘤大小相关。PTT后,AuNRs@SiO2-CAA通过监测HOCl水平有效反映炎症的严重程度。在未来,AuNRs@SiO2-CAA介导的HOCl PA成像有望实现治疗期间的精确炎症控制,从而增强PTT的疗效,降低炎症对PTT治疗结果的负面影响。 通讯作者简介:  张润博士是澳大利亚昆士兰大学生物工程与纳米技术研究所(AIBN UQ),昆士兰农业和食品创新联盟营养与食品科学研究中心(CNAFS,QAAFI)的高级研究员。他于2012年在大连理工大学获得分析化学博士学位,随后在麦考瑞大学(MQ)担任博士后(2012),并于2013获麦考瑞大学校聘青年人才计划(MQRF)支持。2016年,他加入了昆士兰大学,并于2017年(ARC DECRA)、2019年(NHMRC Investigator)连续获得澳大利亚国家级青年人才计划支持,带领团队致力于开发用于生物、食品及环境样本实时在线分析检测方法;诊疗型纳米材料用于疾病的早期诊断、治疗及疗效评估等研究工作。已在Nature Photonics, JACS,Angew. Chem., Anal. Chem., Coord. Chem. Rev., 和Acc. Chem. Res.等期刊发表论文 170 余篇,总被引8,000 余次, H指数51。担任TrAC Trend. Anal. Chem., Aggregate, Chem. Asian J., Methods等国际期刊编辑、编委等学术职务。 |