 医疗器械公共服务平台  服务平台 | 上饶>> 青岛>> 淄博>>研发中心 | 广州>> 深圳>> 上海>> 柏林>>专业服务 | 医工转化>> 研发设计>> 生产制造>> 全球临床试验>> 全球注册>> 医械云>>  近年来,软件在医疗器械和更广泛的数字化应用中变得越来越重要。此外,它本身作为一种医疗设备的重要性也在提升。 技术的快速创新推动了软件功能和应用的重大变化,也催生了越来越多能够辅助临床决策,甚至直接为个人提供治疗的设备。计算技术和软件开发的进步使得市场上基于软件的医疗器械数量大幅增加,因此实施改革以确保患者安全也迫在眉睫。 基于软件的医疗器械是指包含软件、或本身就是软件的医疗器械,包括作为医疗器械的软件,或依赖特定硬件按预期运行的软件。这些医疗器械在澳大利亚受到治疗产品管理局(TGA)的监管。 对于这些基于软件的医疗器械,TGA发布的指南提供了关于监管的详细信息,旨在帮助制造商了解并遵守TGA的要求。 TGA就以下问题进行了详细说明,例如:产品是否属于医疗器械范畴;TGA对基于软件的医疗器械的监管办法;临床决策辅助软件(CDSS)的相关信息;网络安全问题;(基于软件的)有源医疗器械的分类方式;数字心理健康软件的相关信息;以及制造商宣传策略等方面。 本指南目前只是初版,未来还可能会增加更新内容,奥咨达也会持续关注进展。如您想了解更多信息,或有其他问题,欢迎联系我们。 奥咨达可提供英国、欧盟、美国、瑞士等世界范围代理服务,如您想了解更多信息,欢迎联系我们。 奥咨达提供全球医疗器械法规、注册及全球质量体系整体解决方案。已帮助全球5000多个医生、科研专家、创新企业,转化出3000余张全球医疗器械证书,其中NMPA证书2000多张、CE证书800多张,FDA证书300多张。 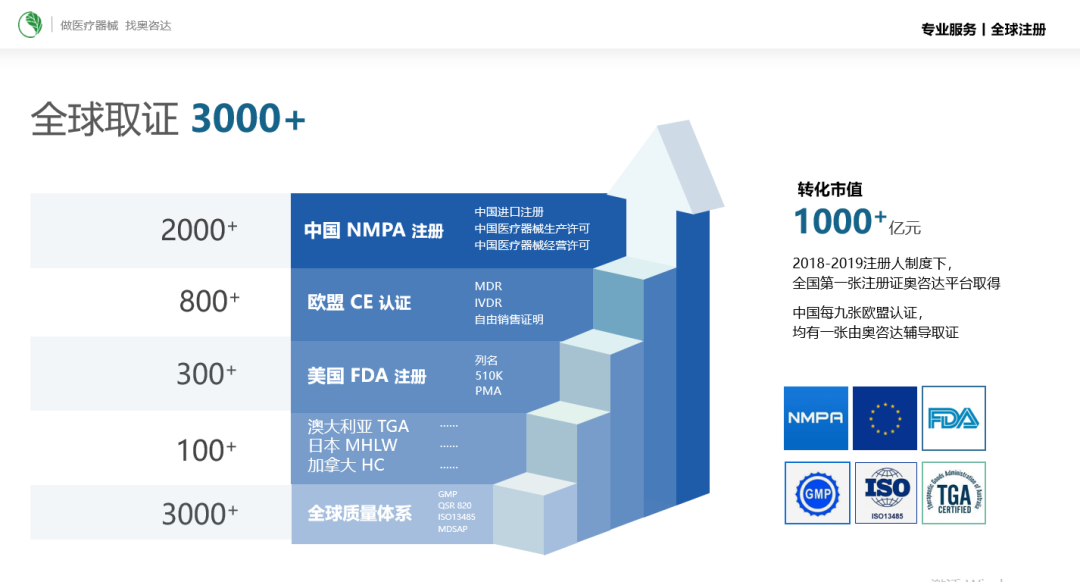 服务包括: 中国NMPA注册、欧盟CE认证、美国FDA注册、加拿大HC注册、澳大利亚TGA注册、日本MHLW注册、全球代理人服务(欧洲代理人,英国代理人;瑞士代理人等),以及GMP、ISO、820、MDSAP等质量体系认证。 OSMUNDA 关于 奥咨达 奥咨达创建于2004年,是全球领先的医疗器械产业服务商和区域医械产业运营商。 借助5000家全球客户、3000张全球证书的服务经验和行业资源积累,提供一站式医工转化、研发设计、全球注册、全球临床试验、生产智造5大专业集成服务,通过创建“区域公共平台+医械云+专业服务”3C产业新生态(CDMO+CMD+CRO),推动区域医疗器械产业数字化和产业高质量发展。    |